Поговорим о том, как составить химическое уравнение, ведь именно они являются основными элементами данной дисциплины. Благодаря глубокому осознанию всех закономерностей взаимодействий и веществ, можно управлять ими, применять их в различных сферах деятельности.
Теоретические особенности
Составление химических уравнений - важный и ответственный этап, рассматриваемый в восьмом классе общеобразовательных школ. Что должно предшествовать данному этапу? Прежде чем педагог расскажет своим воспитанникам о том, как составить химическое уравнение, важно познакомить школьников с термином «валентность», научить их определять данную величину у металлов и неметаллов, пользуясь таблицей элементов Менделеева.

Составление бинарных формул по валентности
Для того чтобы понять, как составить химическое уравнение по валентности, для начала нужно научиться составлять формулы соединений, состоящих из двух элементов, пользуясь валентностью. Предлагаем алгоритм, который поможет справиться с поставленной задачей. Например, необходимо составить формулу оксида натрия.
Сначала важно учесть, что тот химический элемент, который в названии упоминается последним, в формуле должен располагаться на первом месте. В нашем случае первым будет записываться в формуле натрий, вторым кислород. Напомним, что оксидами называют бинарные соединения, в которых последним (вторым) элементом обязательно должен быть кислород со степенью окисления -2 (валентностью 2). Далее по таблице Менделеева необходимо определить валентности каждого из двух элементов. Для этого используем определенные правила.
Так как натрий - металл, который располагается в главной подгруппе 1 группы, его валентность является неизменной величиной, она равна I.
Кислород - это неметалл, поскольку в оксиде он стоит последним, для определения его валентности мы из восьми (число групп) вычитаем 6 (группу, в которой находится кислород), получаем, что валентность кислорода равна II.
Между определенными валентностями находим наименьшее общее кратное, затем делим его на валентность каждого из элементов, получаем их индексы. Записываем готовую формулу Na 2 O.

Инструкция по составлению уравнения
А теперь подробнее поговорим о том, как составить химическое уравнение. Сначала рассмотрим теоретические моменты, затем перейдем к конкретным примерам. Итак, составление химических уравнений предполагает определенный порядок действий.
- 1-й этап. Прочитав предложенное задание, необходимо определить, какие именно химические вещества должны присутствовать в левой части уравнения. Между исходными компонентами ставится знак «+».
- 2-й этап. После знака равенства необходимо составить формулу продукта реакции. При выполнении подобных действий потребуется алгоритм составления формул бинарных соединений, рассмотренный нами выше.
- 3-й этап. Проверяем количество атомов каждого элемента до и после химического взаимодействия, в случае необходимости ставим дополнительные коэффициенты перед формулами.

Пример реакции горения
Попробуем разобраться в том, как составить химическое уравнение горения магния, пользуясь алгоритмом. В левой части уравнения записываем через сумму магний и кислород. Не забываем о том, что кислород является двухатомной молекулой, поэтому у него необходимо поставить индекс 2. После знака равенства составляем формулу получаемого после реакции продукта. Им будет в котором первым записан магний, а вторым в формуле поставим кислород. Далее по таблице химических элементов определяем валентности. Магний, находящийся во 2 группе (главной подгруппе), имеет постоянную валентность II, у кислорода путем вычитания 8 - 6 также получаем валентность II.
Запись процесса будет иметь вид: Mg+O 2 =MgO.
Для того чтобы уравнение соответствовало закону сохранения массы веществ, необходимо расставить коэффициенты. Сначала проверяем количество кислорода до реакции, после завершения процесса. Так как было 2 атома кислорода, а образовался всего один, в правой части перед формулой оксида магния необходимо добавить коэффициент 2. Далее считаем число атомов магния до и после процесса. В результате взаимодействия получилось 2 магния, следовательно, в левой части перед простым веществом магнием также необходим коэффициент 2.
Итоговый вид реакции: 2Mg+O 2 =2MgO.
Пример реакции замещения
Любой конспект по химии содержит описание разных видов взаимодействий.
В отличие от соединения, в замещении и в левой, и в правой части уравнения будет два вещества. Допустим, необходимо написать реакцию взаимодействия между цинком и Алгоритм написания используем стандартный. Сначала в левой части через сумму пишем цинк и соляную кислоту, в правой части составляем формулы получаемых продуктов реакции. Так как в электрохимическом ряду напряжений металлов цинк располагается до водорода, в данном процессе он вытесняет из кислоты молекулярный водород, образует хлорид цинка. В результате получаем следующую запись: Zn+HCL=ZnCl 2 +H 2 .
Теперь переходим к уравниванию количества атомов каждого элемента. Так как в левой части хлора был один атом, а после взаимодействия их стало два, перед формулой соляной кислоты необходимо поставить коэффициент 2.
В итоге получаем готовое уравнение реакции, соответствующее закону сохранения массы веществ: Zn+2HCL=ZnCl 2 +H 2 .

Заключение
Типичный конспект по химии обязательно содержит несколько химических превращений. Ни один раздел этой науки не ограничивается простым словесным описанием превращений, процессов растворения, выпаривания, обязательно все подтверждается уравнениями. Специфика химии заключается в том, что с все процессы, которые происходят между разными неорганическими либо органическими веществами, можно описать с помощью коэффициентов, индексов.
Чем еще отличается от других наук химия? Химические уравнения помогают не только описывать происходящие превращения, но и проводить по ним количественные вычисления, благодаря которым можно осуществлять лабораторное и промышленное получение разных веществ.
Если ты уже учишься в университете, но до сих пор так и не освоил основы решения задач по химии, это можно назвать настоящим чудом. Однако, вряд ли такое чудо прокатит и во время сдачи сессии.
Как сдавать экзамены в целом, вы узнаете на нашем телеграм-канале . А чтобы не оплошать на занятиях по химии, давайте выяснять, что же необходимо, чтобы таки начать самому выполнять решение практических задач по химии.
Химия: глубоко системная наука
Что в школе (8-9 класс), что в вузе схема решения задач по химии примерно одинакова. Существует определенный набор определенных химических веществ. Каждое из этих веществ обладает определенными характеристиками.
Понимая систему этой науки в целом, а также систему и суть основных веществ, даже будучи гуманитарием до глубины души вы сможете выучить и понять правила решения задач по химии.
А для этого вам понадобятся:
- Необходимая мотивация и готовность работать. Если есть цель и трудолюбие, то все у вас получится, поверьте!
- Хотя бы базовое знание теории: таблица Менделеева, минимальный глоссарий, знание простейших формул соединений и т.д.
- Внимательность. Часто многие проблемы в решении задач химии студенты испытывают из-за банальной невнимательности. Очень тщательно читайте условие задачи, спишите все краткие данные и определите, что же все-таки нужно найти. А дальше все просто – следуем стандартному алгоритму действий.
Волшебный алгоритм решения задач по химии (для ОГЭ и вузов)
А вот и она - волшебная схема решения стандартных задач по химии, благодаря которой вы сможете ответить на экзамене хотя бы на минимальную проходную оценку:
- Для начала запишите уравнение реакции (если требуется). При этом важно не забывать о расстановке коэффициентов.
- Попытайтесь определить, как найти неизвестные данные, сколько действий для этого понадобится, нужно ли для этого использовать таблицу Менделеева (например, чтобы выяснить молекулярную массу) или прочие справочные данные.
- Теперь, если нужно, самое время составить пропорцию или применить понятие количества вещества. Или же в необходимую формулу подставить известную или найденную величину.
- Если в задаче нужно использовать формулу, обращайте внимание на единицы измерений. Нередко требуется их перевод в систему СИ.
- Когда решение найдено и вы расслабились, не спешите – перечитайте условие задачи еще раз. Бывает, что студент начал не с того. В тоге все это время он занимался поиском совершенно не того, что требуется.
А вот еще несколько примеров решения задач по химии, которые вы вполне можете использовать в качестве примера и тщательно проанализировать:



На самом деле, решение задач по химии – дело не такое уж и сложное. Конечно, нам легко говорить, ведь за плечами наших авторов – многолетний опыт решения не только простейших, но и мега-супер-бупер-крутых по сложности задач. И если вам попалась одна из таких, не стесняйтесь обращаться за помощью в студенческий сервис , здесь вам никто никогда не откажет!
Кстати, чуть ниже вы можете посмотреть краткое видео с наглядными примерами решения задач по химии:
Закон сохранения массы веществ, открытый М. В. Ломоносовым в 1748 г., гласит:
Материальными носителями массы веществ являются атомы химических элементов, из которых состоят как вступившие в реакцию вещества (реагенты), так и образовавшиеся в результате её новые вещества (продукты реакции). Поскольку при химических реакциях атомы не образуются и не разрушаются, а происходит лишь их перегруппировка, то становится очевидным справедливость открытого М. В. Ломоносовым и подтверждённого позднее А. Лавуазье закона.
В справедливости закона сохранения массы веществ можно легко убедиться на простом опыте. Поместим в колбу немного красного фосфора, закроем её пробкой и взвесим на весах (рис. 96). Затем колбу осторожно нагреем. О том, что произошла химическая реакция, можно определить по появлению в колбе густого белого дыма, состоящего из оксида фосфора (V), который образовался при взаимодействии фосфора с кислородом. При повторном взвешивании колбы с продуктами этой реакции мы убедимся, что масса веществ в колбе не изменилась, хотя и произошло превращение фосфора в его оксид.
Рис. 96.
Экспериментальная проверка закона сохранения массы веществ:
а - взвешивание колбы с фосфором до реакции; б - горение фосфора в закрытой колбе; в - взвешивание колбы с продуктом реакции
Этот же вывод будет нами сделан и при проведении ещё одного простого, но очень наглядного опыта. В специальный сосуд нальём отдельно соляную кислоту и раствор щёлочи, например гидроксида натрия (рис. 97). К раствору щёлочи добавим несколько капель индикатора - фенолфталеина, отчего раствор окрасится в малиновый цвет. Закроем прибор пробкой, уравновесим гирями на весах, отметим массу, а затем сольём растворы. Малиновая окраска исчезнет, потому что кислота и щёлочь прореагировали друг с другом. Масса же сосуда с полученными продуктами реакции не изменилась.

Рис. 97.
Опыт, подтверждающий закон сохранения массы вещества
Аналогичное наблюдение сделал и автор закона сохранения массы веществ М. В. Ломоносов, который проводил опыты в запаянных стеклянных сосудах, «дабы исследовать, прибывает ли вес металла от чистого жару», и обнаружил, что «без пропущения внешнего воздуха вес металлов остаётся в одной мере».
На основании этого закона пишут химические предложения, т. е. составляют уравнения химических реакций с помощью химических слов - формул.
В левой части уравнения записывают формулы (формулу) веществ, вступивших в реакцию, соединяя их знаком «плюс». В правой части уравнения записывают формулы (формулу) образующихся веществ, также соединённых знаком «плюс». Между частями уравнения ставят стрелку. Затем находят коэффициенты - числа, стоящие перед формулами веществ, чтобы число атомов одинаковых элементов в левой и правой частях уравнения было равным.
Запишем, например, уравнение реакции водорода с кислородом. Сначала составим схему реакции - укажем формулы веществ, вступающих в реакцию (водород Н 2 и кислород O 2) и образующихся в результате её (вода Н 2 O), и соединим их стрелкой:
Н 2 + O 2 → Н 2 O (рис. 98, а).

Рис. 98.
Составление уравнения реакции взаимодействия водорода и кислорода
Так как число атомов кислорода в левой части вдвое больше, чем в правой, запишем перед формулой воды коэффициент 2:
Н 2 + O 2 → 2Н 2 O (рис. 98, б).
Но теперь в правой части уравнения стало четыре атома водорода, а в левой их осталось два. Чтобы уравнять число атомов водорода, запишем перед его формулой в левой части коэффициент 2. Так как мы уравняли число атомов каждого элемента в левой и правой частях уравнения, заменим стрелку на знак равенства:
2Н 2 + O 2 = 2Н 2 O (рис. 98, в).
Теперь, наверное, вам понятно, почему такую запись называют уравнением (рис. 99).

Рис. 99.
Закон сохранения массы веществ на примере реакции, уравнение которой 2Н 2 + O 2 = 2Н 2 O
Для составления уравнений химических реакций, кроме знания формул реагентов и продуктов реакции, необходимо верно подобрать коэффициенты.
Это можно сделать, используя несложные правила,
1. Перед формулой простого вещества можно записывать дробный коэффициент, который показывает количество вещества реагирующих и образующихся веществ.
Так, для рассмотренного выше примера:
Н 2 + O 2 → Н 2 O
число атомов кислорода в правой и левой частях уравнения можно сделать равными с помощью коэффициента 1/2, поставив его перед формулой кислорода:
H 2 + 1/2O 2 = H 2 O
Но так как коэффициент показывает не только количество вещества, но и число молекул (атомов), а половину молекулы взять невозможно, лучше переписать приведённое уравнение, удвоив все коэффициенты в нём:
2Н 2 + O 2 = 2Н 2 O.
Приведём ещё пример составления уравнения реакции горения этана С 2 Н 6 , содержащегося в природном газе. Известно, что в результате этого процесса образуются углекислый газ и вода. Схема этой реакции:
С 2 Н 6 + O 2 → СO 2 + Н 2 O.
Уравняем число атомов углерода и водорода:
С 2 Н 6 + O 2 → 2СO 2 + ЗН 2 O.
Теперь в правой части уравнения реакции 7 атомов кислорода, а в левой - только 2. Уравняем число атомов кислорода, записав перед формулой 02 коэффициент 3,5 (7:2 = 3,5):
С 2 Н 6 + 3,5O 2 = 2СO 2 + ЗН 2 O.
И наконец, перепишем полученное уравнение реакции, удвоив коэффициенты перед формулами всех участников реакции:
2С 2 Н 6 + 7O 2 = 4СO 2 + 6Н 2 O.
2. Если в схеме реакции есть формула соли, то вначале уравнивают число ионов, образующих соль.
Например, взаимодействие серной кислоты и гидроксида алюминия описывают схемой:
H 2 SO 4 + Аl(OН) 3 → Al 2 (SO 4) 3 + Н 2 O.
Образующаяся в результате реакции соль - сульфат алюминия Al 2 (SO 4) 3 - состоит из ионов алюминия Аl3+ и сульфат-ионов . Уравняем их число, записав перед формулами H 2 SO 4 и Аl(OН) 3 соответственно коэффициенты 3 и 2:
3H 2 SO 4 + 2Аl(OН) 3 → Al 2 (SO 4) 3 + Н 2 O.
Чтобы уравнять число атомов водорода и кислорода, воспользуемся третьим правилом.
3. Если участвующие в реакции вещества содержат водород и кислород, то атомы водорода уравнивают в предпоследнюю очередь, а атомы кислорода - в последнюю.
Следовательно, уравняем число атомов водорода. В левой части схемы реакции 12 атомов водорода, а в правой - только 2, поэтому перед формулой воды запишем коэффициент 6:
3H 2 SO 4 + 2Аl(OН) 3 → Al 2 (SO 4) 3 + 6Н 2 O.
Индикатором верности расстановки коэффициентов является равенство числа атомов кислорода в левой и правой частях уравнения реакции - по 24 атома кислорода. Поэтому заменим стрелку на знак равенства:
3H 2 SO 4 + 2Аl(OН) 3 = Al 2 (SO 4) 3 + 6Н 2 O.
4. Если в схеме реакции имеется несколько формул солей, то необходимо начинать уравнивание с ионов, входящих в состав соли, содержащей большее их число.
Например, взаимодействие растворов фосфата натрия и нитрата кальция описывают схемой:
Na 3 PO 4 + Ca(NO 3) 2 → Ca 3 (PO 4) 2 + NaNO 3 .
Наибольшее число ионов содержит один из продуктов реакции - фосфат кальция Са 3 (РO 4) 2 , поэтому уравнивают ионы, которыми образована эта соль, - Са 2+ и :
2Na 3 PO 4 + 3Ca(NO 3) 2 → Ca 3 (PO 4) 2 + NaNO 3 .
и, наконец, ионы Na + и N0 - 3:
2Na 3 PO 4 + 3Ca(NO 3) 2 → Ca 3 (PO 4) 2 + 6NaNO 3 .
Ключевые слова и словосочетания
- Химические уравнения.
- Правила подбора коэффициентов в уравнениях реакций.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока - сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания

В уроке 13 «» из курса «Химия для чайников » рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
В результате реакции горения метана CH 4 в кислороде O 2 образуются диоксид углерода CO 2 и вода H 2 O. Эта реакция может быть описана химическим уравнением :
- CH 4 + O 2 → CO 2 + H 2 O (1)
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O 2 расходуется в расчете на 1 молекулу CH 4 и сколько молекул CO 2 и H2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
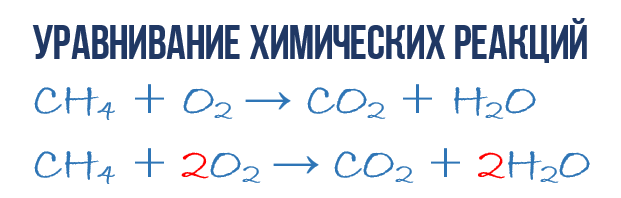
Начнем с углерода. В левой части один атом С входит в состав молекулы CH 4 , а в правой части один атом С входит в состав CO 2 . Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H 4 = 4H) в составе молекулы CH 4 , а в правой – всего 2 атома H в составе молекулы H 2 O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H 2 O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H 2 O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H 2 O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O или СH 4 + 2O 2 → CO 2 + 2H 2 O (4)
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C 7 H 5 N 3 O 6 энергично соединяется с кислородом, образуя H 2 O, CO 2 и N 2 . Запишем уравнение реакции, которое будем уравнивать:
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O 2 . Таким образом полное химическое уравнение будет иметь вид:
- 2C 7 H 5 N 3 O 6 + 10,5O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
- C 7 H 5 N 3 O 6 + 5,25O 2 → 7CO 2 + 2,5H 2 O + 1,5N 2 (10)
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты , а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро N A =6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O 2 с образованием 28 молей CO 2 , 10 молей H 2 O и 6 молей N 2 .
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O2 = 31,999 г/моль
- CO2 = 44,010 г/моль
- H2 O = 18,015 г/моль
- N2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO 2 , 10·18,015 г = 180,15 г H 2 O и 6·28,013 г = 168,08 г N 2 . Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO2 | |
| 671,98 г CO2 | 180,15 г H2 O | |
| 168,08 г N2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2 :
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO 3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 . Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO 3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl 2 (110,99 г/моль), CO 2 (44,01 г/моль) и H 2 O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO 3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
- CaCO 3 (тв.) + 2H + (водн.) → Ca 2+ (водн.) + CO 2 (г.) + H 2 O(ж.) (12)
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO 3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO 2 и H 2 O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений » вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
 la-bazzar.ru Портал о недвижимости. Дом, аренда, прописка. Ипотека.
la-bazzar.ru Портал о недвижимости. Дом, аренда, прописка. Ипотека.